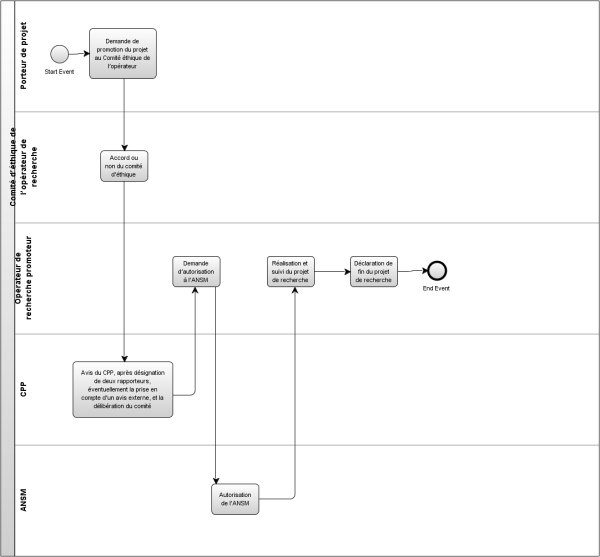
2.3.2 Certifier la conformité éthique des projets biomédicaux
{{#if: 2.3 Obtenir les agréments |
- Parent : 2.3 Obtenir les agréments|}}{{#if: 2.3.1 Délivrer les autorisations de projets utilisant des animaux à des fins scientifiques |
- Précédent: 2.3.1 Délivrer les autorisations de projets utilisant des animaux à des fins scientifiques|}}{{#if: 2.3.3 Délivrer les agréments d'utilisation d'OGM à des fins de recherche |
- Suivant: 2.3.3 Délivrer les agréments d'utilisation d'OGM à des fins de recherche|}}{{#if:
|
- Sous-processus:
Objectifs
Obtenir l'autorisation de mener un projet biomédical
Périmètre
Les recherches biomédicales sont « les recherches organisées et pratiquées sur l'être humain en vue du développement des connaissances biologiques ou médicales ».
Afin de protéger les personnes qui se prêtent à ces recherches, la mise en place de ces projets de recherches biomédicales doit être effectuée dans un cadre spécifique. Ces projets doivent être évalués et validés par plusieurs instances :
- En fonction de la politique de chaque établissement, par un comité éthique indépendant propre à l'établissement, voire un IRB (Institutional Review Board) ;
NB : les Institutional Review Boards (IRB) ont été créés aux Etats-Unis, avec pour mission de garantir le respect des règles éthiques dans les recherches financées par le National Health Service (NHS) ;
- Par un CPPCf. Comités de protection des personnes.
 (Comité de Protection des Personnes), dont l'avis favorable est nécessaire;
(Comité de Protection des Personnes), dont l'avis favorable est nécessaire; - Par l'autorité compétente qui doit donner son autorisation, c.-à-d. l'Agence nationale de sécurité du médicament et des produits de santé (ANSMCf. Agence nationale de sécurité du médicament et des produits de santé
 ). Etablissement public placé sous la tutelle du ministère chargé de la santé, l'agence nationale de sécurité du médicament et des produits de santé (ANSMCf. Agence nationale de sécurité du médicament et des produits de santé
). Etablissement public placé sous la tutelle du ministère chargé de la santé, l'agence nationale de sécurité du médicament et des produits de santé (ANSMCf. Agence nationale de sécurité du médicament et des produits de santé ) a été créée par la loi du 29 décembre 2011. Elle a pour missions principales d'offrir un accès équitable à l'innovation pour tous les patients et de garantir la sécurité des produits de santé tout au long de leur cycle de vie, depuis les essais initiaux jusqu'à la surveillance après autorisation de mise sur le marché.
) a été créée par la loi du 29 décembre 2011. Elle a pour missions principales d'offrir un accès équitable à l'innovation pour tous les patients et de garantir la sécurité des produits de santé tout au long de leur cycle de vie, depuis les essais initiaux jusqu'à la surveillance après autorisation de mise sur le marché.
D'autres types de projets nécessitent d'avoir un avis de conformité éthique du projet. Par exemple :
- Les projets pour lesquels le financeur fait expressément la demande d'avoir un avis éthique ;
- La signature de certains contrats ;
- Ou plus simplement la réalisation de certaines publications.
Nota : Les recherches portant sur les embryons humains, depuis 2013 (Loi n° 2013-715 du 6 août 2013 tendant à modifier la loi n° 2011-814 du 7 juillet 2011 relative à la bioéthique en autorisant sous certaines conditions la recherche sur l'embryon et les cellules souches embryonnaires) sont encadrées tant sur leurs protocoles que sur les différentes démarches à respecter en matière d'autorisation et de conservation des embryons humains. L'Agence de Biomédecine est chargée de l'encadrement, et s'assure à chaque étape de la conformité avec le cadre légal et les règles éthiques. Ses décisions sont publiées au journal officiel.
Certains projets internationaux demandent à ce que le comité éthique soit certifié en tant qu'IRB.
Le comité éthique du CNRS ne l'étant pas, le CEEI / IRB (Comité d'Evaluation Ethique de l'Inserm) peut réaliser l'évaluation éthique de ce type de projet du CNRS.
Dans le cadre d'un projet de recherche biomédicale :
- Le promoteur est la personne physique ou la personne morale qui prend l'initiative d'une recherche biomédicale sur l'être humain, qui en assure la gestion et qui vérifie que son financement est prévu ;
- Les investigateurs sont les personnes physiques qui dirigent et surveillent la réalisation de la recherche sur un lieu ;
- Le coordinateur est un des investigateurs désignés par le promoteur, dans le cas où plusieurs investigateurs existent.
Les CPPCf. Comités de protection des personnes.![]() (comités de protection des personnes) sont des comités indépendants, dotés d'une personnalité juridique, agréés au niveau régional ou interrégional pour une durée déterminée, avec une compétence sur un territoire donné. Leurs membres sont nommés par le représentant de l'Etat dans la région. Avant de réaliser une recherche biomédicale sur l'être humain, le promoteur est tenu d'en soumettre le projet à l'avis de l'un des comités de protection compétents pour le lieu où l'investigateur ou, le cas échéant, l'investigateur coordonnateur, exerce son activité. Actuellement, il existe 40 CPPCf. Comités de protection des personnes.
(comités de protection des personnes) sont des comités indépendants, dotés d'une personnalité juridique, agréés au niveau régional ou interrégional pour une durée déterminée, avec une compétence sur un territoire donné. Leurs membres sont nommés par le représentant de l'Etat dans la région. Avant de réaliser une recherche biomédicale sur l'être humain, le promoteur est tenu d'en soumettre le projet à l'avis de l'un des comités de protection compétents pour le lieu où l'investigateur ou, le cas échéant, l'investigateur coordonnateur, exerce son activité. Actuellement, il existe 40 CPPCf. Comités de protection des personnes.![]() réparties sur 7 inter-régions de recherche clinique. Le promoteur d'un projet de recherche biomédicale doit saisir l'un des CPPCf. Comités de protection des personnes.
réparties sur 7 inter-régions de recherche clinique. Le promoteur d'un projet de recherche biomédicale doit saisir l'un des CPPCf. Comités de protection des personnes.![]() compétents de l'inter-région où exerce l'investigateur principal de l'étude.
compétents de l'inter-région où exerce l'investigateur principal de l'étude.
Les CPPCf. Comités de protection des personnes.![]() comportent 14 membres titulaires et 14 suppléants en deux collèges :
comportent 14 membres titulaires et 14 suppléants en deux collèges :
- 7 membres appartenant au monde médical, médecins qualifiés en matière de recherche (4, dont un méthodologiste au moins), médecin généraliste (1), pharmacien (1) et infirmier(e)s (1) ;
- 7 membres appartenant à la « société civile », dont un qualifié en matière d'éthique, un qualifié dans le domaine social, un psychologue, deux juristes et deux représentants d'associations agréées de malades ou d'usagers du système de santé.
Description du processus
En entrée
- Demande d'autorisation
En sortie
- Autorisation accordée
- Déclaration de fin de projet de recherche
Synthèse descriptive
Liste des flux d'échange
Services attendus par les systèmes d'information
Au niveau national
Préalablement au dépôt d'une demande d'autorisation et d'avis de recherche biomédicale portant sur un médicament à usage humain, les promoteurs doivent obtenir un numéro d'enregistrement de la recherche dans la base de données européenne des essais cliniques de médicaments à usage humain, dénommée EudraCT, établie par l'Agence européenne des médicaments. Ce numéro, dénommé numéro EudraCT, est destiné à identifier chaque recherche biomédicale conduite dans un ou plusieurs lieux de recherches situés sur le territoire de la Communauté européenne. Le numéro EudraCT doit impérativement être rappelé dans chacun des dossiers ou correspondances envoyés à l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() ou aux CPPCf. Comités de protection des personnes.
ou aux CPPCf. Comités de protection des personnes.![]() .
.
Pour ce faire, le promoteur suit la procédure indiquée sur le site internet de l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() (ictaxercb.ANSMCf. Agence nationale de sécurité du médicament et des produits de santé
(ictaxercb.ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() .fr). Ce numéro identifie la recherche et sera à mentionner sur tous les documents correspondants à cette recherche. Après cette démarche, le promoteur obtient ainsi un justificatif qui sera versé dans les dossiers de demande d'AEC pour l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé
.fr). Ce numéro identifie la recherche et sera à mentionner sur tous les documents correspondants à cette recherche. Après cette démarche, le promoteur obtient ainsi un justificatif qui sera versé dans les dossiers de demande d'AEC pour l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() et de demande d'avis pour le CPPCf. Comités de protection des personnes.
et de demande d'avis pour le CPPCf. Comités de protection des personnes.![]() . Ce numéro d'enregistrement est demandé au promoteur pour tout contact ultérieur ou envoi de documents.
. Ce numéro d'enregistrement est demandé au promoteur pour tout contact ultérieur ou envoi de documents.
Pour quelques pathologies spécifiques (sida, hépatites, cancers, maladies rares), plusieurs institutions proposent, en coordination avec l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() , des registres spécialisés. Ces registres contiennent les principales informations concernant l'essai. D'autres informations complémentaires peuvent être obtenues auprès du promoteur de chaque essai.
, des registres spécialisés. Ces registres contiennent les principales informations concernant l'essai. D'autres informations complémentaires peuvent être obtenues auprès du promoteur de chaque essai.
- Cancer : Registre des essais cliniques de l'INCa
- Sida et hépatites : Répertoire des études cliniques de l'ANRS
- Maladies rares : Base de données "Recherche et essais cliniques" d'Orphanet
- Toutes maladies : Répertoire public des essais cliniques de médicaments, registre des essais cliniques de l'Agence européenne du médicament : EU clinical trials register
Dans le cadre de la simplification administrative
Actuellement la demande d'autorisation fait l'objet d'un formulaire au format Word à remplir manuellement. Le cadre de cohérence SI recherche préconise une dématérialisation complète des échanges entre le déposant et l'ANSMCf. Agence nationale de sécurité du médicament et des produits de santé![]() .
.
Au niveau de la structure de recherche portant le projet
- Les étapes présentées plus haut doivent être tracées dans le système de gestion de la structure de recherche et rattachées au projet concerné.
- Le numéro d'autorisation doit être tracé et rattaché au projet.
- Les informations administratives concernant la structure de recherche demandeuse d'agrément doivent pouvoir être pré-alimentées dans la télé procédure, à partir du référentiel national des structures de recherche.
Procédure de déclaration de conformité en matière de traitement des données personnelles opérées dans le cadre des recherches biomédicales
La CNIL (Commission Nationale de l'Informatique et des libertés) a mis en place une procédure simplifiée de déclaration de conformité, en homologuant une méthodologie de référence pour les traitements de données personnelles mis en œuvre dans le cadre des recherches biomédicales traduisant ainsi, dans le secteur de la recherche, la volonté de simplifier les formalités pour des applications conduites dans le cadre d'exigences législatives et réglementaires strictes (source : cnil.fr).
Un seul engagement de conformité, adressé directement à la CNIL, est suffisant dès lors que le traitement mis en œuvre est conforme à la méthodologie de référence. Cette méthodologie de référence décrit précisément les modalités d'identification de la personne.
En synthèse
- L'identification de la personne doit se limiter à un numéro d'ordre ou un code alphanumérique pouvant correspondre aux trois premières lettres du nom. Il est toutefois désormais recommandé de se limiter aux seules initiales dès lors qu'un numéro est également attribué à l'inclusion.
- Le lieu de naissance peut être enregistré dans le cadre des informations signalétiques et les variations génétiques (polymorphismes génétiques et/ou variations de l'expression des gènes) peuvent être collectées.